杭州华安生物技术有限公司品牌商
8 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
小白必备实验干货:标签及标签抗体!
891 人阅读发布时间:2025-02-27 13:38

蛋白标签通常是通过人工方式附加到目标蛋白上的,而非蛋白质本身天然存在的结构。在分子生物学实验中,通常采用基因工程技术,将编码标签的DNA序列通过分子克隆的方式插入到目标蛋白基因的特定位置。这些标签可以是短肽序列(通常为5-15个氨基酸)或较大的功能性蛋白结构域(如GFP等)。经过合理设计的标签通常不会显著影响目标蛋白的生物学功能,其潜在干扰效应可通过优化标签位置、连接序列(linker)等策略降至最低。目前常用的蛋白标签主要可分为以下几类:
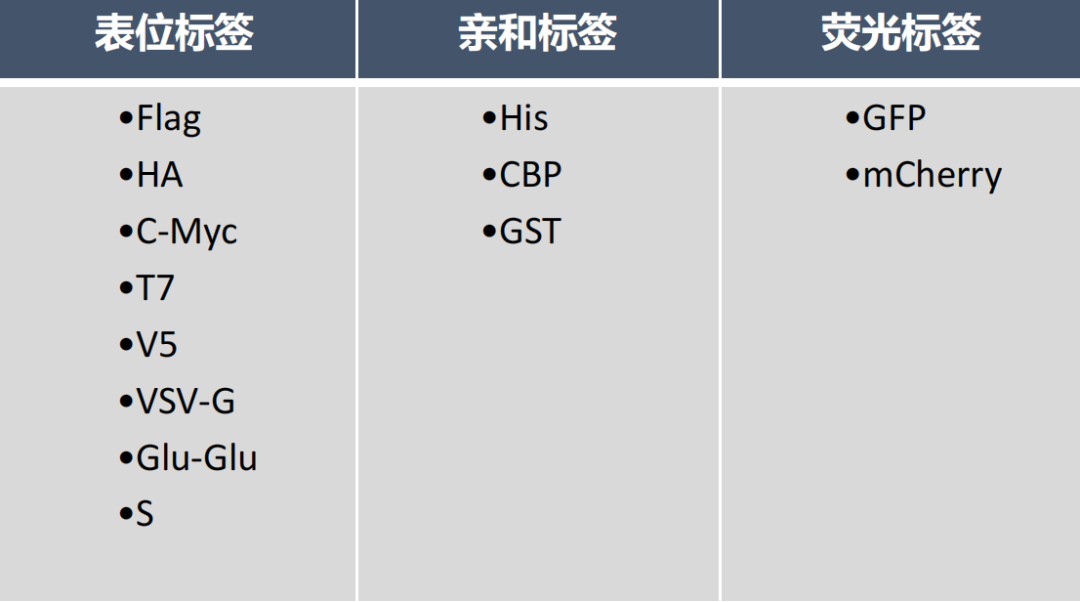
表位标签(Epitope Tag):
表位标签是指能够被特定抗体识别的一段短肽序列(通常为6-12个氨基酸)。这类标签因其与抗体结合的特异性,在基于抗体的蛋白质检测技术中应用广泛,如蛋白质印迹(Western Blot,WB)、免疫共沉淀(Co-Immunoprecipitation,Co-IP)和免疫荧光染色等实验。常见的表位标签包括HA标签、Myc标签和FLAG标签等。
亲和标签(Affinity Tag):
亲和标签是一类能够与特定配体发生特异性结合的蛋白或多肽序列,主要用于蛋白质的分离纯化。这类标签通过其与固定化配体(如镍离子、谷胱甘肽等)的特异性结合,可从复杂的细胞裂解液中高效纯化目标蛋白。同时,某些亲和标签还具有增强蛋白溶解度的功能。常见的亲和标签包括His标签、GST标签和MBP标签等。
荧光标签(Fluorescent Tag):
荧光标签是指具有自发荧光特性的蛋白或多肽序列,可用于活细胞和固定细胞的实时成像研究。这类标签在亚细胞定位、蛋白质相互作用和动态过程观察等研究中具有重要应用价值。常用的荧光标签包括绿色荧光蛋白(GFP)、红色荧光蛋白(RFP)及其衍生变体等。
那么为什么要人工引入标签呢?
人工引入蛋白标签的主要目的是为了克服天然蛋白质在实验研究中的局限性,为蛋白质的检测、纯化和功能研究提供便利。具体来说,蛋白标签的引入具有以下重要意义:
提高检测灵敏度:通过引入表位标签,可以利用高特异性的抗体进行检测,显著提高目标蛋白的检测灵敏度,特别是在低丰度蛋白的研究中。
简化纯化流程:亲和标签的引入使得目标蛋白可以通过简单的亲和层析步骤从复杂的细胞裂解液中高效纯化,大大简化了蛋白质纯化的流程。
实现实时监测:荧光标签的引入使得研究人员可以在活细胞中实时观察目标蛋白的定位、表达和动态变化。
增强蛋白稳定性:某些标签(如MBP标签)可以提高重组蛋白的溶解性和稳定性,有助于难表达蛋白的研究。
以His标签的具体应用为例:
假设研究人员需要研究混合样品中的蛋白质X,可以通过以下步骤实现目标蛋白的特异性纯化:
1.基因工程改造:
1)将细胞裂解液上样至镍离子亲和层析柱;
2)His标签与柱中的镍离子发生特异性结合;
3)通过咪唑梯度洗脱,获得高纯度的目标蛋白X。
高特异性:仅纯化带有His标签的目标蛋白;
高效率:一步纯化即可获得较高纯度的蛋白;
通用性:适用于多种表达系统和蛋白类型;
可扩展性:可用于实验室规模或工业化生产。
DYKDDDDK标签
DYKDDDDK标签的分子量为1.01 kDa,大小为8个氨基酸(DYKDDDDK)。标签可以位于目标蛋白的C-端、N-端或内部。其亲和树脂为固定化DDDK抗体,广泛应用于ELISA、Western Blot、蛋白纯化以及蛋白结晶等实验中。相比于其他表位标签,DYKDDDDK标签的亲水性较高,因而较少影响融合蛋白的功能。该标签还包含肠激酶切割序列,使其在需要时能够轻松从目标蛋白中去除。然而,亲和树脂的稳定性较其他树脂稍差,并且价格相对较高。
HA标签
人流感血凝素 (HA) 标签来源于 HA 糖蛋白,存在于流感病毒表面,是造成病毒传染性的主要原因。HA标签的分子量为1.1 kDa,大小为9个氨基酸(YPYDVPDYA)。标签可以位于目标蛋白的C-端或N-端。其亲和树脂为固定在琼脂糖微珠上的HA抗体,广泛应用于ELISA、Western Blot、免疫沉淀、免疫荧光以及蛋白纯化等实验中。由于HA标签为小型多肽,其对目标蛋白功能的影响较小,是进行ELISA、Western Blot、免疫沉淀和免疫荧光检测的有价值工具。此外,抗HA抗体可以结合固定在琼脂糖微珠上,方便用于蛋白纯化。然而,HA标签不适合用于凋亡细胞,因为Cas3/7酶能够切割该标签。
His标签
His标签是一种广泛应用于蛋白质纯化的小分子亲和标签,分子量范围为0.2-1.6 kDa。其中,6XHis标签分子量为0.8 kDa,由6个连续的组氨酸残基(His-His-His-His-His-His)组成。该标签系统具有灵活的定位特性,可根据实验需求将其插入目标蛋白的N端、C端或特定内部位置。6XHis标签能够与过渡金属离子(如Ni²⁺、Co²⁺等)形成稳定的配位键,从而实现蛋白质的亲和纯化。6x-His标签体积较小,对融合蛋白功能的影响较低,并且不会产生包涵体,这些优势使其成为蛋白质纯化中最常用的标签之一。同时,在哺乳动物和昆虫细胞表达系统中,内源性His残基可能与标签抗体非特异性结合,导致目标蛋白的回收率降低。此外,对于具有金属中心的蛋白,建议避免将其与His标签融合,因为金属可能会被亲和树脂吸附,从而影响实验结果。对于厌氧条件下的实验,应避免使用His标签,因为这些条件可能会削弱亲和树脂的效能。
GFP标签
绿色荧光蛋白(GFP)标签是一种革命性的分子生物学工具,广泛用于蛋白质标记和动态追踪研究。该标签由238个氨基酸构成,分子量约为27 kDa,可灵活地融合在目标蛋白的N端、C端或特定内部位置。GFP最显著的特征是其自发荧光能力——在蓝光激发下可发射绿色荧光,且不需要额外添加底物或辅因子。因此,GFP标签适用于活细胞实时成像、蛋白亚细胞定位、蛋白相互作用分析、基因表达监测和细胞示踪等实验。GFP标签的核心优势体现在它的非侵入性、高灵敏度和多功能性。它能够与其他荧光蛋白结合进行多重标记,用于目标的蛋白空间和时间分布的分析。需要指出的是,GFP标签也存在一些局限性:GFP标签的分子量较上述蛋白标签大很多,可能影响某些目标蛋白的功能;长时间的激发可能会导致荧光漂白;某些背景信号可能干扰GFP的荧光检测,并且需要特定的荧光显微镜进行检测。在使用时,建议根据实验的需求选择合适的GFP变体(如EGFP)并优化实验条件,尤其是在多重标记实验中,需要确保不同荧光蛋白的光谱特性不重叠。
在实验应用中,标签及标签抗体的使用可能面临以下几个常见问题:
标签的选择不当:由于不同标签蛋白的特性存在差异,每个标签都有其适用的场景,有些对目标蛋白的结构和性质也有要求。如果选择了与目标蛋白不兼容的标签,可能会影响蛋白的表达和纯化,甚至影响目标蛋白的功能。如果选择了与目标蛋白不兼容的标签,可能会影响蛋白的表达、纯化或功能。
标签抗体多批次混用:商品化的抗体可能会由于生产批次不同而表现出略微的性能差异。标签抗体可能会与其他非目标蛋白发生非特异结合,从而影响实验结果的准确性。通过选用固定批次的抗体、验证抗体特异性、优化实验条件和使用对照实验,可以有效减少批次间差异带来的影响,提高实验结果的可靠性和重复性。
背景信号过高:在免疫检测实验(如Western blot、免疫沉淀)中,标签抗体可能与非目标蛋白发生非特异结合,从而导致背景信号过高。其原因主要包括标签抗体使用过量、目标蛋白表达量低和标签抗体的交叉反应。例如,DYKDDDDK标签抗体有时可能与细胞膜上的某些蛋白发生非特异性结合,导致假阳性结果。
减少背景的方法:使用适当的封闭剂、优化抗体稀释比例或使用专门针对标签的高亲和力抗体,可以有效减少背景噪音。
标签的大小和位置:标签可能影响目标蛋白的折叠、功能或稳定性。例如,His标签或Myc标签如果位于蛋白的活性部位附近,可能会干扰蛋白的正常功能。在设计实验时,建议选择不会影响目标蛋白功能的标签,或者选择可逆性较好的标签(如C端和N端标签)。
标签引起的蛋白聚集:某些标签可能会导致蛋白聚集或不溶,尤其是在高浓度或在某些表达系统中。这可能会影响后续的蛋白纯化与分析。
不同物种之间的兼容性:与其他抗体类似,标签抗体也具有特定的种属来源(如小鼠、兔子、山羊等)。因此,在设计实验时,必须确保抗体的种属来源与实验样本的物种兼容,以避免交叉反应和非特异性信号。例如:当使用小鼠来源的标签抗体检测小鼠组织样本时,二抗(如抗小鼠IgG)可能会与样本中的内源性小鼠IgG发生反应,导致高背景信号或假阳性结果。此外,如果二抗与样本中的内源性免疫球蛋白结合,也会掩盖特异性信号,进而影响实验结果的准确性。
抗体亲和力不足:如果标签抗体的亲和力较低,可能无法有效结合目标蛋白,导致检测信号弱或难以检测。
优化抗体滴定:不同实验的抗体稀释度和条件需要通过预实验优化。过高的抗体浓度可能导致特异性结合减少,而过低则可能导致信号不清晰。
不同检测方法的兼容性:不同标签在各种实验方法(如免疫沉淀、免疫荧光、ELISA、Western blot等)中的表现可能存在显著差异。某些标签在特定实验中的效果可能不理想,甚至不适合直接检测。例如:His标签抗体在亲和纯化和ELISA中表现良好,但在免疫荧光中可能因背景信号高而受限。为了确保实验结果的准确性和可靠性,在选择标签和标签抗体时,建议根据实验的具体要求进行评估和优化。
HUABIO开发出覆盖多靶标、多种属来源的优质标签抗体,为您提供高质量的科研检测工具。
此外,为答谢广大科研用户对华安生物的支持与厚爱,HUABIO更特别推出“标签一口价”促销活动,为您的科研工作提供更高性价比的选择,让研究变得简单。

联系我们了解更多活动详情





